






Посттрансляционная модификация белковКраткое описание: Статья с сайта Биомолекула (http://biomolecula.ru/content/1226) о посттрансляционных модификациях белков. Посттрансляционные модификации и функциональное разнообразие белковКаждая клетка любого организма содержит набор генетической информации, реализация которой в природе подчиняется центральной догме молекулярной биологии: информация передаётся от нуклеиновых кислот к белку, но не в обратном направлении. Правило было сформулировано Френсисом Криком еще в 1958 году [1]. Переход генетической информации от ДНК к РНК и от РНК к белку является универсальным для всех без исключения клеточных организмов, и лежит в основе биосинтеза макромолекул. Процесс перехода ДНК→РНК называется транскрипцией, а процесс перехода РНК→белок — трансляцией (рис. 1). Исходя из этих малых знаний можно предположить, что посттрансляционные модификации — это процесс регуляции на уровне белка. Зачем же они нужны клетке? Разве не достаточно перехода от ДНК к РНК и от РНК к белкам? Оказывается, что нет — этого недостаточно. В клетке любого организма присутствует огромное количество функционально различающихся белков: структурные белки (необходимы для строения клеточной стенки и мембран), ферменты (необходимы для каталитических процессов), регуляторные белки (исполняют роль регуляторов экспрессии генов, транскрипционные факторы) и т.д. Иногда один белок может выполнять разные функции в клетке одного и того же организма, и этому способствуют как раз посттрансляционные модификации (ПТМ). ПТМ заключаются в ковалентной модификации белков, транслированных с РНК. Они играют ключевую роль в гетерогенности белков, в исключении идентичных белков, их деградации, тканеспецифичности, регуляции активности. Например, ПТМ осуществляемые на N-конце1,* полипептидной цепи, способствуют транспорту белков через биологические мембраны. N-гликозилирование белков происходит по карбоксамидному атому азота остатка аспарагина в последовательности Asn-X-Ser/Thr. Многие белки, а именно относящиеся к секреторным белкам прокариот и эукариот, а также белки, транспортируемые в клеточные органеллы — лизосомы, хлоропласты, митохондрии, — содержат моносахаридный остаток N-ацетилглюкозамина [2]. * — Цифрами в верхнем индексе помечены термины, разъясненные в Словарике в конце статьи. Благодаря ПТМ в клетках эукариот может достигаться большое разнообразие функционально активных белков и транскрипционных факторов. Так, 20 с небольшим тысяч генов, содержащихся в ДНК человека [3], транскрибируемых в РНК и транслируемых в белки, в результате ПТМ дают от 300 000 до миллиона функционально различных белков в клетке. Например, известный транскрипционный фактор р53, выполняющий роль опухолевого супрессора и принимающий участие в регуляции клеточного цикла, подвергается нескольким ПТМ, а именно — фосфорилированию, ацетилированию и гликозилированию. Данные ПТМ помогают белку р53 увеличить количество участков связывания с ДНК. Таким образом, ПТМ необходимы для изменения конформации, клеточной локализации, активности ферментов и транскрипционных факторов, регуляции белок-белковых взаимодействий и контроля продолжительности «жизни» белков. ПТМ белков могут осуществляться несколькими способами. На сегодняшний день известно более 100 ПТМ. Наиболее распространенными и изученными являются:
Каждый тип ПТМ осуществляется специальными ферментами: известно 500 протеинкиназ (фосфорилирование), 150 фосфатаз, 500 протеаз, небольшое количество гистоновых2 ацетилаз (ацетилирование) и деацетилаз (деацетилирование) [4]. Одной из самых распространенных ПТМ белков является фосфорилирование. Анализ белков в клеточной линии человека HeLa [5] показал, что фосфорилируется более чем 20000 белков по более чем 6000 позициям (сайтам). Фосфорилирование важно для рецепторов, осуществляющих передачу сигнала извне клетки в цитоплазму и ядро. Интересно, что белки могут подвергаться нескольким ПТМ одновременно, и в этом случае одна ПТМ может как усиливать, так и ослаблять эффект другой модификации. Вы можете спросить: «А как долго существуют белки в клетке, бесконечно ли их время жизни?». Белки в клетке не только все время синтезируются, но и расщепляются. (Аналогичная динамика наблюдается и для РНК [6].) Данный процесс осуществляется при участии белка убиквитина [7], а соответствующая ПТМ называется убиквитинилирование — ацилирование белков активированной С-концевой карбоксильной группой остатка глицина убиквитина. Убиквитинилирование приводит к деградации «меченого» белка с направлением его в протеасому. В Сумоилирование — уникальная посттрансляционная модификацияИтак, что же это за уникальная посттрансляционная модификация? Какую роль выполняет в сумоилировании белок SUMO? Как было описано выше, сумоилирование осуществляется с участием небольшого убиквитин-подобного модифицирующиего белка SUMO, состоящего всего из ~100 аминокислотных остатков (молекулярный вес ≈11—12 кДа) (рис. 2). 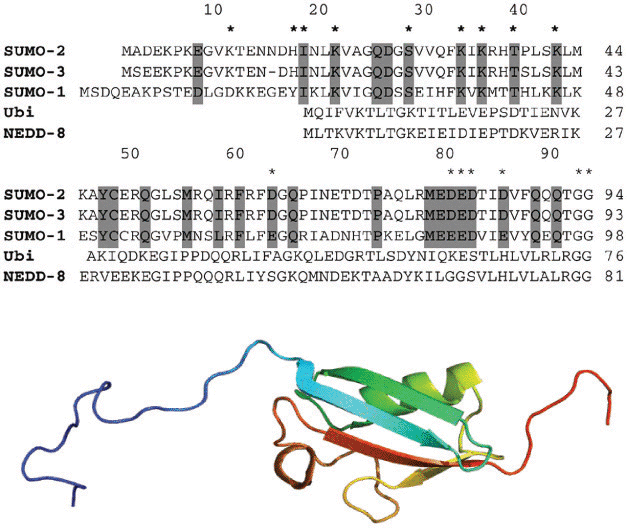 Рисунок 2. Строение белка SUMO. На верхнем рисунке представлена аминокислотная последовательность белков SUMO, а также показано выравнивание аминокислотных последовательностей с убиквитином. Серым цветом выделены гомологичные аминокислоты. На нижнем рисунке представлена пространственная структура белка SUMO1 человека. Синий конец — N-конец белка, красный — С-конец. Сумоилирование является эволюционно высококонсервативным процессом от дрожжей до человека. SUMO экспрессируется во всех эукариотических организмах (дрожжи, растения, животные), но отсутствует у бактерий (однако присутствует у архей). У дрожжей, червей и насекомых экспрессируется одна изоформа3 SUMO. У позвоночных животных определено несколько изоформ — SUMO1, SUMO2, SUMO3 (рис. 2), которые встречаются во всех тканях, и SUMO4, который является псевдогеном4. Несмотря на то, что механизм конъюгации SUMO идентичен для всех трех изоформ, разные формы белка характеризуются разными функциональными особенностями. Так, мышиные эмбрионы, лишенные SUMO1, погибают: это говорит о том, что SUMO2/3 не могут компенсировать отсутствие SUMO1 в клетках млекопитающих Давайте вместе рассмотрим процесс сумоилирования, насколько «силен» такой маленький белок, и можно ли его сравнить с тяжеловесными борцами сумо. Вспомним центральную догму молекулярной биологии: ДНК→РНК→белок. Белок SUMO синтезируется по такому же принципу (ДНК→РНК→SUMO). Но только что синтезированный белок SUMO не может запустить процесс сумоилирования и осуществить конъюгацию белков-субстратов. Чтобы стать активным, ему сначала приходится подвергнуться протеолизу5. Протеолиз белка SUMO осуществляется на С-конце полипептидной цепи, освобождая два остатка аминокислоты глицина — GG. Данная стадия процесса сумоилирования называется «созревание» и осуществляется SUMO-специфическими протеолитическими ферментами — SENP-протеазы у млекопитающих и Ulp-протеазы у дрожжей. Далее наш маленький белок SUMO активируется Е1-активирующим ферментом (гетеродимер Aos1/Uba2) и переносится на фермент Е2 (Ubc9). После этапа активации SUMO конъюгируется с субстратом в реакции, которая катализируется ферментами Е3 (рис. 3). Как и в случае убиквитинилирования, на молекулу белка-субстрата может переноситься как один остаток SUMO (моносумоилирование), так и несколько (полисумоилирование). Помимо сумоилирования, бывает и десумоилирование. В данном случае SUMO высвобождается из субстрата в реакции, катализируемой семейством изопептидаз, названных SENP — SUMO-специфические протеолитические ферменты (рис. 3). Таким, образом, маленький белок SUMO прибегает к помощи многих дополнительных белков-ферментов, а иногда даже «зазывает напарников», как в случае полисумоилирования. В такой ситуации можно сказать, что наш SUMO уступает профессиональным борцам сумо. Но так ли это на самом деле, мы можем оценить, только рассмотрев функциональную значимость данной посттрансляционной модификации. 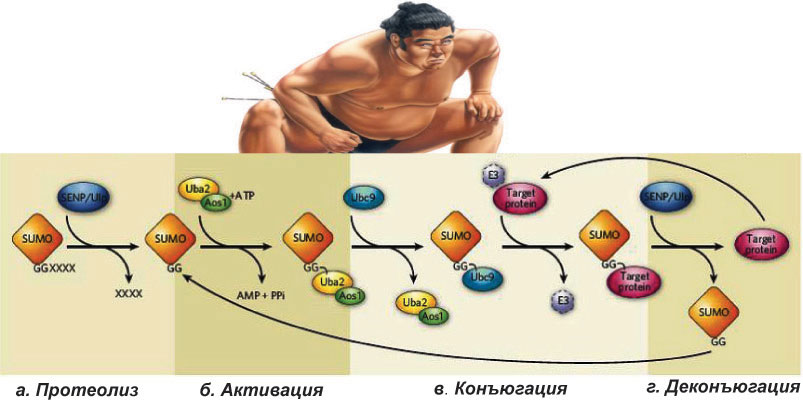 Рисунок 3. SUMO: ковалентная модификация белков. a — протеолиз или «созревание» — SUMO подвергается протеолизу SENP/Ulp протеазами; б — «активация» SUMO ферментами Uba/Aos1; в — «конъюгация» SUMO с белком-субстратом; г — «SUMO-деконъюгация». Функциональная значимость SUMO и сумоилированияКак было уже отмечено ранее, первой найденной мишенью для сумоилирования оказался белок RanGAP1, изучение которого впервые показало связь между ядерным транспортом и SUMO. Конъюгация SUMO с RanGAP1 осуществляется через RanBP2 — ядерный белок: такая модификация важна для ядерного транспорта и локализации RanGAP1. Потеря сумоилирования может привести к нарушению ядерного транспорта RanGAP1 для осуществления его нормальной функции. Кроме этого, сумоилирование RanGAP1 важно для митотической функции Ran [11]. Интересен тот факт, что сумоилирование может быть вовлечено в патогенез многих нейродегенеративных заболеваний. Показано, что сумоилирование необходимо для ядерного транспорта фактора DJ-1, который подавляет транскрипционную активность апоптотического белка р53, и мутации в котором зачастую связаны с развитием ранней аутосомно-рецессивной формы болезни Паркинсона [12]. Сумоилирование может быть ассоциировано как с подавлением транскрипции, так и с активацией. Например, сумоилирование таких транскрипционных факторов, как Sp3, p300, Изучение ПТМ метил-ДНК-связывающих белков показало, что сумоилирование играет немаловажную роль в регуляции их активности. Так, например, сумоилирование метил-ДНК-связывающего белка MBD1, с одной стороны, не препятствует связыванию с метилированной ДНК, а с другой — наличие этой модификации приводит к потере репрессионной активности MBD1 [15]. Функциональная значимость полисумоилирования остается еще малоизученной. Тем не менее, была показана структурная роль SUMO-2/3 цепей в клетках млекопитающих. Был найден белок CENP-E, который подвергается полисумоилированию SUMO-2/3 и локализуется к кинетохорам7, что является важным для выравнивания хромосом в стадии метафазы во время митоза [9]. Существуют версии, что полисумоилирование может, как и убиквитинилирование, приводить к деградации белков. Так, например, показано, что опухолевый супрессор PML может подвергаться полисумоилированию и деградации 26S-протеасомой. Полисумоилирование может влиять на другие ПТМ за счет экранирования сайтов связывания белка-субстрата с ферментами, принимающими участие в ПТМ [9]. Подводя итоги знакомства с новым маленьким конкурентом борьбы сумо, можно смело говорить о его огромной значимости и необходимости для регуляции широкого спектра клеточных процессов во всех живых организмах от дрожжей до человека. Полученные знания о белке SUMO могут быть интересны не только для любителей японского искусства, но и для почитателей биологии. Словарик
Литература
Автор: Жигалова Надежда. Источник: http://biomolecula.ru/content/1226 Ваша оценка:
|